Maladies chroniques de l'intestin
Syndrome de l’intestin irritable
Quels sont la fréquence et l’impact du syndrome de l’intestin irritable (SII) en termes de santé publique?
Le syndrome de l’intestin irritable est une entité clinique dont la prévalence, la répercussion sur la qualité de vie des individus et les coûts de santé générés sont importants.
Le syndrome de l’intestin irritable est un trouble gastro-intestinal chronique dont la prévalence est estimée en Europe et Amérique du Nord entre 10 et 15% [1] et l’incidence mondiale entre 196 et 260 pour 100 000 personnes / an [2]. Il concerne le plus souvent des adultes entre 20 et 30 ans, deux fois plus souvent les hommes que les femmes. Les études récentes indiquent qu’il y a également une prévalence significative chez les personnes âgées [3].
Le SII a des répercussions importantes sur la qualité de vie des patients influençant le fonctionnement social, la qualité du sommeil, les capacités relationnelles.
Comparativement àla population générale il est plus souvent associé àdes troubles dépressifs (30% vs 18%) ou anxieux (16% vs 6%) ; les patients se plaignant de SSI consultent leur médecin plus souvent (1,6 consultation/3 mois versus 0,8), consomment plus de médicaments (69% des patients consomment des médicaments pour des symptômes liés au SII) et s’absentent du travail plus souvent (5,5 jours/an versus 3,1) [4,5].
La majorité des consultations pour SII se font en soins de premiers recours (77% vs 43% en gastroentérologie). Aux USA le SII est responsable de plus de 3 millions de consultations ambulatoires annuelles et 5,9 millions de prescriptions pour un coût total de 20 milliards de dollars.
Références:
[4] Syndrome de l’intestin irritable : un diagnostic d’exclusion? Rev Med Suisse 2012 ; 8 : 1821-5.
Qualité de la preuve: niveau 2.
Mots clés : Syndrome du colon irritable – épidémiologie [Irritable bowel syndrome – epidemiology].
Sur quels éléments cliniques évoquer un syndrome de l’intestin irritable ?
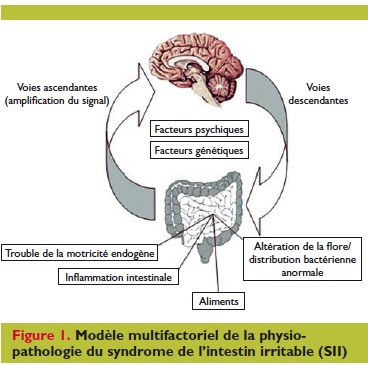
Le SII répond àun modèle multifactoriel et la première difficulté est d’établir un profil symptomatique du patient.
Le SII ne correspond pas àune entité clinique bien définie mais àun ensemble de causes diverses : altération de la flore, de la motricité et de la perméabilité intestinales, modifications des défenses immunitaires, interactions neuro-végétatives, y compris le statut psycho-social [1].
Certains symptômes sont caractéristiques. Le diagnostic doit être évoqué chez un patient présentant depuis au moins 6 mois des douleurs ou un inconfort abdominal, soulagé par la défécation ou associé àune modification de la fréquence et de la forme des selles [2,3].
Pour retenir le diagnostic de SII ces troubles doivent être accompagnés d’au moins deux des quatre symptômes suivants [2,3].
- Troubles de la défécation (obligation de forcer, urgences, sensations d’exonération incomplète ;
- Ballonnement abdominal (plus fréquent chez la femme que chez l’homme) avec modification du transit intestinal ;
- Aggravation par l’ingestion d’aliments ;
- Émission de glaires.
D’autres symptômes tels que léthargie, nausées, dorsalgies, douleurs vésicales, lien avec des facteurs émotionnels sont fréquents et peuvent aider àétayer le diagnostic [1-3]. Environ 20% des patients ayant des problèmes d’incontinence sphinctérienne en parleront mais seulement si la question est posée.
Les critères de Rome III sont actuellement utilisés comme critères de référence : douleurs ou inconfort au moins 3 jours / mois depuis au moins 6 mois + amélioration par la défécation et/ou modification de la fréquence et/ou de la consistance des selles. Ils définissent 3 sous-groupes compte tenu de l’aspect des selles mieux corrélé que leur fréquence àl’évaluation du transit : SSI avec diarrhée (SSI-D= selles défaites > 25% du temps et selles dures < 25%) plus fréquent chez l’homme, avec constipation (SSI-C = selles dures > 25% et selles molles < 25%) plus fréquent chez la femme, et mixte (SSI-M = selles molles et selles dures > 25%). Ils permettront d’orienter le traitement [4].
La douleur et l’inconfort abdominal sont les symptômes clés. Il est important de préciser leur siège qui peut être n’importe où dans l’abdomen et leurs variations et de rechercher systématiquement des signes d’alarme de pathologie organique justifiant des explorations complémentaires [2].
Références
Qualité de la preuve : niveau 3
Mots clés: Syndrome du colon irritable – diagnostic [Irritable bowel syndrome – diagnosis].
Qu’est-il important de rechercher chez un patient présentant des symptômes d’intestin irritable?
La recherche par l’interrogatoire et l’examen clinique de signes d’alarme (Red flags) est essentielle pour identifier les patients présentant une plus grande probabilité de pathologie organique et nécessitant une prise en charge spécifique [1,2].
Signes d’alerte de pathologie organique :
- Survenue après 50 ans ;
- Aggravation progressive des symptômes ;
- Perte de poids non intentionnelle et inexpliquée ;
- Modifications du transit intestinal avec selles plus liquides et/ou plus fréquentes ;
- Diarrhée nocturne ;
- Rectorragies ou melÃ…“na;
- Anomalies àl’examen clinique (masse abdominale, signes d’anémie).
- Antécédents familiaux de pathologies gastro-intestinales, de cancer du colon ou de l’ovaire, de maladie cÃ…“liaque, de maladie inflammatoire de l’intestin;
Origine iatrogène alimentaire ou médicamenteuse:
- Calcium, magnésium, fer ;
- Antihistaminiques, AINS, antibiotiques, antidépresseurs, antiparkinsoniens, antipsychotiques, inhibiteurs calciques, diurétiques, metformine, opioïdes, sympathicomimétiques [1-3].
Références :
Qualité de la preuve : niveau 3
Mots clés : Syndrome du colon irritable – diagnostic [Irritable bowel syndrome – diagnosis].
Comment confirmer le diagnostic ?
En l’absence de tout signe d’alarme les patients qui remplissent tous les critères cliniques de diagnostic de SII ne présentent pas plus souvent de maladie organique intestinale que les patients asymptomatiques[1].
Il existe une grande incertitude concernant les limites et associations entre SII et maladie inflammatoire intestinale. Les données de la littérature et les recommandations internationales (American College of Gastroenterology Task Force, World Gastroenterolgy Organisation, British Society of Gastroenterology) suggèrent que chez les patients qui remplissent les critères cIiniques de SII sans signe d’alarme le diagnostic peut être posé avec confiance sur la base de la clinique seule [1,2].
Coloscopie: une étude cas contrôle (466 patients suspects de SII et 451 témoins en bonne santé) a montré une prévalence de lésions inflammatoires microscopiques de 1,5% (7/466) dans le groupe SII et 2,3% dans le groupe témoin ≥ 45 ans : une coloscopie de routine n’est donc pas justifiée chez des patients présentant des signes caractéristiques de SII sans autre signe d’appel.
Calprotectine fécale et CRP : au vu des différentes études ayant évalué l’apport de ces tests sanguins et/ou examens de selles [1-3], il n’y a aucune preuve de leur intérêt. Ils ne sont donc pas recommandés en routine chez des patients présentant des signes caractéristiques de SSI en dehors de signes d’alarme évocateurs de maladie inflammatoire : risque de maladie inflammatoire intestinale <1% si calprotectine fécale (hors nomenclature) <40μg/g ou CRP <0,5 mg/dl [3].
Seule exception, la maladie cÃ…“liaque qui semble présenter une prévalence supérieure chez les personnes souffrant de SSI par rapport àla population générale. La recherche d’anticorps anti-endomysium et antitransglutaminase est recommandée chez les patients présentant un SII avec diarrhée ou mixte [1,4].
La surveillance, la non réponse au traitement malgré une prise en charge optimale, l’apparition de nouveaux symptômes qui évoqueraient une maladie organique associée détermineront l’indication d’explorations complémentaires.
Références:
Qualité de la preuve : niveau 3
Mots clés: Syndrome du colon irritable – diagnostic [Irritable bowel syndrome – diagnosis].
Quels traitements peut-on proposer?
La prise en charge du SII repose sur une approche individuelle globale incluant le mode de vie, la diététique, les traitements médicaux et comportementaux [1].
D’abord une démarche éducative: être àl’écoute du patient, s’enquérir de son mode de vie (alimentation, sédentarité), informer sur la nature des troubles, leur bénignité et la visée symptomatique des traitements disponibles [2].
Conseils diététiques : prendre le temps de manger ; éviter de sauter des repas ; boire au moins 8 verres de liquide/jour : eau, boissons non caféinées, tisanes ; limiter café, thé (3 tasses/jour), alcool et boissons gazeuses ; limiter légumineuses, maïs, pommes de terre insuffisamment cuites, banane, pain (non digérés dans l’intestin grêle), fruits (3 portions d’environ 80g/jour [Grade C]) ; céréales d’avoine le matin ou 1 cuiller àsoupe/jour de graines de lin en cas de ballonnements; éviter le sorbitol (boissons, friandises et produits sans sucre) en cas de diarrhée prédominante [2].
Fibres : dans 17 études (1363 patients), les fibres insolubles (son de blé et maïs) ont le même effet que le placebo et peuvent aggraver les symptômes. Leur consommation doit être adaptée ; en cas de constipation prédominante, privilégier les fibres solubles (poudre de spaghula ou flocons d’avoine) (Grade C) [2,3].
Probiotiques: une étude observationnelle sur 76 patients consommant 2 yaourts/jour, enrichis (43 patients) ou non (33) en probiotiques n’a pas montré, à4 semaines, de différence significative entre les deux groupes, actif et placebo (57% vs 53% ; p = 0,71) [4].
Un régime d’exclusion ne sera envisagé, si les symptômes persistent, qu’après avis diététique spécialisé. Une allergie est rare mais une intolérance est fréquente, par exemple aux fibres insolubles.
Activité physique. Dans une étude chez 39 patients (moyenne d’âge 45 ans) suivis 5,2 ans, passer de 3,2 à5,2 h/semaine d’activité physique améliorait le score de sévérité du SII (218 vs 276 ; p=0,001), la qualité de vie, la fatigue, la dépression, et l’anxiété [5].
Références.
Qualité de la preuve: niveau 3
Mots clés: Syndrome du colon irritable – traitement [Irritable bowel syndrome –treatment].
Quelle est l’efficacité des divers traitements médicamenteux?
Dans tous les essais randomisés l’effet placebo des médicaments est important, représentant près de 47%.
Antispasmodiques anticholinergiques ou musculotropes : une méta analyse (56 études et 3725 patients) [1] a montré qu’ils sont significativement plus efficaces que le placebo sur les douleurs abdominales (RR 1,32 ; IC 95% 1,12 – 1,55 ; p<0,001 ; NNT = 7), le bien être global (1,49 ; 1,25-1,77 ; p<0,0001 ; NNT = 5) et le score de sévérité (1,86 ; 1,26 – 2,76 ; p<0,01 ; NNT=3).
Antidépresseurs : la même méta analyse a montré un bénéfice significatif des antidépresseurs sur les douleurs abdominales (RR 1,49 ; 1,05-2,12 ; p = 0,03 ; NNT = 5), le bien être global (1,57 ; 1,23-2,00 ; p < 0,001 ; NNT = 4), le score de sévérité (1,99 ; 1,32-2,99; p = 0,001; NNT = 4). Les IRSS étaient plus efficaces sur le bien être global, les tricycliques sur les douleurs abdominales et le score de sévérité.
Modificateurs du transit: laxatifs (sauf lactulose) ou ralentisseurs (lopéramide), selon la prédominance de constipation ou de diarrhée, en ajustant la dose àla réponse clinique [2].
Références:
Qualité de la preuve: niveau 3
Mots clés : Syndrome du colon irritable – traitements médicamenteux [Irritable bowel syndrome – drug therapy].