Différences entre les versions de « Helicobacter pylori »
| Ligne 5 : | Ligne 5 : | ||
Vous devez pour cela vous entrer votre question ou votre commentaire [https://docs.google.com/forms/d/1lHgWVKt_iajyWnu-2rPbX5MBsLSGOM7bRspv93Bu-og/viewform en utilisant notre formulaire en ligne ici...] | Vous devez pour cela vous entrer votre question ou votre commentaire [https://docs.google.com/forms/d/1lHgWVKt_iajyWnu-2rPbX5MBsLSGOM7bRspv93Bu-og/viewform en utilisant notre formulaire en ligne ici...] | ||
---- | ---- | ||
==Quelle est la fréquence de l’infection à Helicobacter pylori ?== | ==Quelle est la fréquence de l’infection à Helicobacter pylori ?== | ||
Version actuelle datée du 28 novembre 2018 à 18:41
Projet collaboratif et formulaire pour poster vos questions et/ou vos commentaires
Ce wiki est un projet collaboratif, auquel chacun peut apporter sa pierre, soit par les questions issues de sa pratique pour lesquelles les réponses sont incertaines ou absentes, soit par les réponses qu'il souhaite lui-même apporter.
Vous devez pour cela vous entrer votre question ou votre commentaire en utilisant notre formulaire en ligne ici...
Quelle est la fréquence de l’infection à Helicobacter pylori ?
L’infection à Helicobacter pylori (HP) est l’infection bactérienne chronique la plus répandue au monde.
L’Helicobacter pylori est une bactérie qui infecte la muqueuse gastrique. L’infection par H. pylori se fait dans l’enfance, principalement dans les cinq premières années de la vie. La transmission de l’infection est principalement interhumaine et intrafamiliale par voie fécale-orale et/ou orale-orale. Elle est possible via la salive contaminée ou les vomissures. Elle est probablement due aux contacts réguliers entre les personnes, ou à l’exposition à une même source d’infection. Elle est facilitée chez les nourrissons et enfants, période à laquelle une certaine immaturité́ épithéliale gastrique se combine à une tendance à porter tout à la bouche. En dehors de la famille, la fréquentation d’une crèche ou la vie en institution serait également un facteur de risque d’infection [1].
Sa prévalence est plus importante dans les pays en voie de développement et dans les milieux défavorisés où elle atteint jusqu’à 80-90 % de la population des jeunes adultes. Dans les pays développés, une réduction progressive du taux d’infection dans la petite enfance a été observée dans les cohortes de naissance successives. Elle se traduit par une diminution de la prévalence globale de l’infection [1,2].
En France, 5 à 10 % des enfants et 10 à 50 % des adultes sont infectés en fonction de leurs tranches d’âge et conservent cette bactérie tout au long de la vie tant qu’elle n’a pas été éradiquée. Actuellement, 1 personne sur 2 de plus de 60 ans héberge cette bactérie dans son estomac [2].
Références : [1] Calvet X, Lázaro M-JR, Lehours P, Mégraud F. Diagnosis and Epidemiology of Helicobacter pylori Infection. Helicobacter. 18(s1):5-11.
[2] de Korwin JD. Épidémiologie de l’infection à Helicobacter pylori et du cancer gastrique. Rev Prat 2014;64:189-93.
Qualité de la preuve : niveau 1
Mots clés : campilobacter pylori ; épidémiologie [campilobacter pylori ; epidemiology]
Quelles sont les conséquences de l’infection à Helicobacter pylori ?
L’infection à Helicobacter pylori a été impliquée dans de nombreuses affections digestives ou extradigestives.
L’infection à HP est responsable d’une gastrite aiguë de durée brève, en général quelques jours, à la suite de l’ingestion de la bactérie, suivie par l’installation progressive d’une gastrite chronique dont l’évolution détermine les manifestations ultérieures de l’infection.
Chez la majorité des patients infectés, cette gastrite chronique active est modérée et généralement asymptomatique, sans maladie associée digestive.
On considère que seulement 20 % des patients infectés vont développer des maladies digestives associées, dans lesquelles le rôle de HP est démontré, mais d’importance variable. Il s’agit principalement de :
- Ulcère gastrique ou duodénal ;
- Manifestations dyspeptiques non liées à un ulcère (dyspepsie fonctionnelle) ; - Cancer gastrique ;
- Lymphome gastrique dérivé du MALT (mucosal associated lymphoid tissue)
- Formes rares de gastrite chronique (gastrite lymphocytaire, gastrite hypertrophique) [1,2].
De nombreuses études épidémiologiques et études in vitro ont montré des liens possibles entre l’infection à HP et certaines pathologies extradigestives [3] :
- Purpura thrombopénique idiopathique ; anémies ferriprives inexpliquées ; urticaire chronique idiopathique.
- Athérosclérose: association faible avec la cardiopathie ischémique et les AVC (niveau de preuve faible).
- Un lien supposé avec la maladie de Parkinson.
L’infection à HP joue un rôle majeur dans le développement des ulcères gastroduodénaux et des cancers gastriques (adénocarcinomes et lymphomes du MALT) [4].
Références: [1] de Korwin JD. Recommandations d’éradication de Helicobacter pylori en 2008. Mini-revue. Hepato-Gastro 2008 ;15(5) :363-70.
[3] De Korwin JD. Existe-t-il des manifestations extradigestives de l’infection à Helicobacter pylori ? Presse Med. 2008 ;37(3P2) :525-34.
Qualité de la preuve : niveau 1 & 3
Mots clés : campilobacter pylori ; maladies de l’appareil digestif ; tumeurs de l’estomac [campilobacter pylori ; digestive system diseases ; stomach neoplasms].
Faut-il dépister systématiquement l’infection à Helicobacter pylori ?
Les autorités sanitaires françaises se sont prononcées en 2010 contre l’opportunité d’un dépistage systématique de l’infection à HP en population générale asymptomatique en France.
« Les inconvénients causés par le dépistage et les interventions étant nombreux au regard d’avantages incertains » en juin 2017, un dépistage ciblé est recommandé et une mise à jour des indications de la recherche de l’infection est publiée par la HAS [1].
Chez les sujets asymptomatiques présentant un antécédent familial au 1er degré de cancer gastrique, qui présentent un risque accru de cancer gastrique, et chez les sujets asymptomatiques recevant un traitement par AINS au long cours qui présentent un risque accru d’ulcère gastrique, la HAS recommande le dépistage et le traitement de l’infection à Helicobacter pylori, en conformité avec le consensus européen Maastricht III [2].
La stratégie diagnostique recommandée vise la recherche d’HP dans des indications précises couplées à des moyens diagnostiques [2,3].
Références: [1] HAS. Dépistage de l’infection à Helicobacter pylori : pertinence et populations concernées. 2010.
[3] [Malfertheiner P, Megraud F, O’Morain C, Bazzoli F, El-Omar E, Graham D, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut. 1 juin 2007;56(6):772‑81].
Qualité de la preuve : niveau 3.
Mots clés : campilobacter pylori ; dépistage [campilobacter pylori ; screening].
Comment faire le diagnostic de l’infection à H. pylori ?
La gastroscopie et la réalisation systématique de biopsies gastriques permettent de rechercher une infection à H. pylori et des lésions pré-néoplasiques [1].
La fibroscopie permet également de réaliser l’examen bactériologique avec évaluation de la sensibilité de la bactérie aux antibiotiques, s’ils sont disponibles, compte tenu des contraintes liées à l’acheminement et à la conservation des échantillons et à la possibilité de réaliser la culture et l’antibiogramme [1].
La culture de la bactérie
Elle est la seule méthode permettant de déterminer sa sensibilité aux antibiotiques. Elle constitue la méthode de référence pour identifier H. pylori. Elle est recommandée chaque fois que possible et particulièrement après échec d’un traitement d’éradication. Elle nécessite un transport rapide des prélèvements dans un milieu spécifique ou une conservation à -80°C et un transport dans la carboglace. Le nombre de laboratoires d’analyses de biologie médicale réalisant ces techniques reste à ce jour limité.
La PCR
Elle est utilisée non seulement pour la détection de la bactérie mais également pour la caractérisation de gènes pathogènes et de mutations spécifiques associées à la résistance aux antimicrobiens [2,3].
L’endoscopie est recommandée pour les pathologies du dépistage ciblé sans signes digestifs à sérologie positive et directement pour les indications ciblées avec signes digestifs :
- patients avec symptômes orientant vers une pathologie digestive haute, notamment les syndromes ulcéreux ;
- dyspepsie chez un patient > 40-45 ans et/ou en cas de symptômes d’alarme dont dysphagie, amaigrissement, anémie ;
- en cas d’anémie chronique ferriprive ou par carence en vitamine B12 sans cause retrouvée ;
- patients avec facteurs de risque de cancer gastrique : personnes > 40-45 ans apparentées à un patient ayant eu un cancer gastrique ;
- patients avec autres facteurs de risque de cancer gastrique, lymphome gastrique du MALT ;
- lorsqu’une intervention de chirurgie bariatrique est prévue [3,5].
La fibroscopie est recommandée pour le diagnostic anatomopathologie de l’infection (de préférence par immunohistochimie) et pour étude de l’activité inflammatoire, de l’atrophie et de la métaplasie intestinale permettant d’évaluer le risque d’évolution vers un cancer en fonction du degré d’étendue et de sévérité des lésions pré-néoplasiques [1].
Références:
Qualité de la preuve: niveau 3
Mots clés : campilobacter pylori ; examens et diagnostics [campilobacter pylori ; examinations and diagnoses].
Comment faire le diagnostic en dehors de l’endoscopie ?
Les méthodes non invasives de diagnostic de l’infection à H. pylori sont la sérologie, le test respiratoire à l’urée marquée (TRUM) et la recherche d’antigènes dans les selles [1].
Le Test Respiratoire à l’Urée Marquée (TRUM)
Il détecte une infection active par la mise en évidence d’une activité uréasique.
Ce test identifie une infection active avec d’excellentes performances et est fortement recommandé pour le contrôle de l’éradication, sous réserve de sa réalisation au moins 4 semaines après l’arrêt des antibiotiques et au moins deux semaines après l’arrêt d’un traitement par inhibiteur de la pompe à protons.
L’indication de ce test est limitée : « surveillance de l’efficacité du traitement d’éradication de l’infection ». Il est non remboursable hors du contrôle de l’éradication [1].
La recherche d’antigène fécal
La recherche d’antigènes d’HP par anticorps monoclonaux identifie une infection active avec d’excellentes valeurs prédictives positives et négatives.
La nécessité de recueillir et manipuler des selles puis de conserver le prélèvement au frais jusqu’à son analyse est un obstacle à la diffusion de la méthode.
En France, ce test (50 € environ), n’est pas pris en charge par l’assurance maladie.
Ce test est recommandé pour « le diagnostic et le contrôle de l’éradication, si le test respiratoire n’est pas réalisable »[1].
La sérologie par test ELISA
En 2008, l’AFSSAPS a réalisé une évaluation comparative de 29 dispositifs médicaux de diagnostic in vitro permettant le diagnostic sérologique IgG de l’infection à H. pylori (17 tests ELISA, 12 tests de diagnostic rapide). Les résultats ont montré une sensibilité diagnostique, un test mis à part (57,8 %), allant de 86,7 à 100 %, une spécificité diagnostique de 57,4 à 97,9 % et un index de performance (pourcentage de sérums bien classés) allant de 73,9 à 97,8 %. La valeur prédictive négative était en général excellente s’échelonnant, sauf pour un test, de 93,2 à 100 %. Quatre trousses présentaient une sensibilité et une spécificité supérieure à 90 %.
La sérologie doit être réalisée avec des kits ELISA (IgG) dont les performances sont supérieures à 90 %. Elle est facilement disponible et son coût est faible (B60, soit 17€ environ).
Elle n’est pas affectée par la prise d’antibiotiques ou d’anti sécrétoire comme les 2 autres tests mais n’est pas adaptée au contrôle post thérapeutique, en raison d’une baisse lente et inconstante du titre des anticorps sériques des mois voire des années après éradication de H. pylori [2,3].
Les tests de diagnostic rapide (TDR) ont montré une moindre fiabilité et une grande hétérogénéité de résultats [2,3].
La sérologie par test ELISA est maintenant recommandée en première intention pour le dépistage des infections à H. pylori sans signe digestifs dans les indications suivantes : - Patients < 40-45 ans;
- Apparentés au premier degré à un patient ayant eu un cancer gastrique ;
- Ou avec antécédent d’ulcère (sans preuve d’éradication de H. pylori et/ou devant prendre des AINS ou de l’aspirine à faible dose) ;
- Ou purpura thrombopénique immunologique.
Une sérologie négative suffit pour éliminer une responsabilité de H. pylori dans ces pathologies. Par contre une sérologie positive est une indication formelle à l’endoscopie gastrique [1,3].
Références:
Qualité de la preuve: niveau 3
Mots clés : campilobacter pylori ; examens et diagnostics [campilobacter pylori ; examinations and diagnoses].
Comment traiter une infection à Helicobacter pylori ?
Il est indispensable d’avoir démontré la présence de l’infection à H. pylori avant tout traitement d’éradication [1].
Un traitement probabiliste
Si, après endoscopie, l’évaluation de la sensibilité de la bactérie aux antibiotiques n’a pu être réalisée, on instaure par défaut un traitement probabiliste avec une quadrithérapie concomitante de 14 jours associant un IPP, l’amoxicilline, la clarithromycine et le métronidazole.
La quadrithérapie « concomitante » remplace le traitement « séquentiel » en raison d’une meilleure efficacité, notamment sur les souches d’HP résistantes à la clarithromycine.
Un contrôle d’éradication doit être réalisé 4 à 6 semaines après la fin du traitement, c’est à dire arrêt des antibiotiques et des IPP, par un Test Respiratoire à l’Urée Marquée (TRUM).
Comment réalise-t-on un test respiratoire à l’urée marquée ?
Le test respiratoire à l’urée marquée (HELIKIT) doit respecter certaines conditions préalables indispensables à sa bonne interprétation [2].
Le test respiratoire à l’urée marquée est un test indirect qui utilise la particularité de Helicobacter pylori de posséder une uréase très puissante. L’uréase bactérienne produite dans l’estomac par cette bactérie hydrolyse l’urée en ammonium et bicarbonate. Sous l’influence de l’acidité gastrique, les bicarbonates vont être transformés en majeure partie en gaz carbonique qui sera absorbé et éliminé par voie respiratoire.
L’ingestion d’urée marquée chez un patient infecté permet de mesurer cet isotope stable dans le gaz carbonique expiré.
Pour être parfaitement interprétable le patient devra :
- Se présenter au laboratoire avec son Kit de prélèvement disponible en pharmacie ;
- Être au repos à jeun depuis 12H et sans tabac depuis la veille ;
- N’ayant pris aucun antibiotique le mois précédent l’examen ;
- Avoir interrompu tout traitement aux IPP depuis 15 jours.
Que faire en cas d’échec du traitement probabiliste ?
En cas d’échec une deuxième ligne de traitement est recommandée [1]:
Une quadrithérapie « avec sels de bismuth » associe pendant 10 jours l’oméprazole avec un sel de bismuth, la tétracycline et le métronidazole.
La quadrithérapie avec bismuth est à privilégier en première intention en cas de prise antérieure de macrolide ou d’allergie à l’amoxicilline [1].
Si après endoscopie une évaluation de la sensibilité aux antibiotiques n’a pu être réalisée un traitement probabiliste est autorisé avec contrôle de l’éradication 4 à 6 semaines après la fin du traitement. En cas d'échec un traitement de 2e ligne est recommandé.
Références
[2] Biolor. Laboratoire de biologie médicale. Test respiratoire à l’urée marquée (HELIKIT).
Qualité de la preuve : niveau 3
Mots clés : campilobacter pylori ; traitement médicamenteux [campilobacter pylori ; drug therapy].
Quel est le traitement recommandé ?
Le traitement doit être guidé dans la mesure du possible en fonction de la résistance aux antibiotiques, notamment à la clarithromycine [1].
La présence d’HP est une indication à la recherche des résistances par PCR (clarythromycine et lévofloxacine) et /ou culture sur les biopsies réalisées lors de l’endoscopie gastrique.
Lorsque l’on dispose d’une étude de la sensibilité aux antibiotiques chez un patient, une trithérapie guidée associant un inhibiteur de la pompe à protons (IPP) et deux antibiotiques pendant 10 jours devrait être la règle:
- IPP+amoxicilline+clarithromycine si la souche est sensible à la clarithromycine;
- IPP+amoxicilline+lévofloxacine en cas de résistance à la clarithromycine.
Devant une double résistance clarithromycine et lévofloxacine une quadrithérapie de 10 j « avec bismuth » est conseillée : en France l’association fixe PYLERA ® (sel de bismuth + tétracycline + métronidazole) + un IPP (inhibiteur de la pompe à protons) [2]. Un TRUM doit être réalisé également dans cette option.
On peut donc être amené à proposer 2 lignes de traitements antibiotiques de 10 à 14 jours (tri ou quadrithérapie) sans certitude d’éradication. Une troisième ligne de traitement requiert un avis du Groupe d’Études Français des Hélicobacters (GEFH) [3] et du centre national de référence des Campylobacters et des Hélicobacters (CNRCH).
Références
[3] Lamarque D, Burucoa C, Courillon-Mallet A, de Korwin JD, Delchier JC, Heluwaert F, Lehours P, Megraud F, Moussata D, Amiot A, Breurec S, Raymond J. Recommandations sur le traitement de l’infection a Helicobacter pylori chez l’adulte. Hepato Gastro 2017 ; 24 : 157-170. doi : 10.1684/hpg.2017.1418.
Qualité de la preuve : niveau 3
Mots clés : campilobacter pylori ; traitement médicamenteux [campilobacter pylori ; drug therapy].
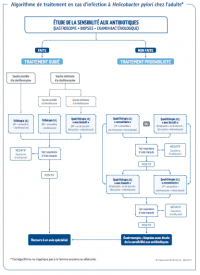
Algorithme - Synthèse des recommandations
Précautions
Dans la mesure où l’information contenue dans les AMM est susceptible d’évoluer, il convient de s’assurer au moment de la prescription du produit du respect notamment, des contre-indications, mises en garde et précautions d’emploi, en ayant un regard tout particulier sur les interactions médicamenteuses.
Se référer à l’information disponible sur la base de données publique des médicaments, accessible par Internet sur la base de données publique des médicaments.
Références
Qualité de la preuve : niveau 3
Mots clés : campilobacter pylori ; traitement médicamenteux [campilobacter pylori ; drug therapy].
Quels sont les facteurs d’échec des traitements ?
Les résistances.
La résistance primaire à la clarithromycine, aujourd’hui > 20%, est un facteur majeur d’échec de l’éradication d’HP.
Une vaste enquête menée pour la troisième fois par le CNRCH, pour évaluer la résistance d’HP aux antimicrobiens a été réalisée en France en 2014 : 984 patients ont été recrutés par 75 gastro-entérologues répartis dans le pays [1].
- Parmi les 783 patients qui n'avaient jamais reçu de traitement d'éradication auparavant, 266 (33,9%) étaient positifs pour HP. Parmi eux 59 souches (22% ; IC95% : 17,3-27,7) présentaient une résistance à la clarithromycine, 41 (15,4% ; 11,3-20,3) à la lévofloxacine et 121 (45,9% ; 39,8-52,1) au métronidazole.
- 187 patients avaient reçu un traitement antérieur, dont 115 étaient HP positifs avec 85 souches (73,9% ; 64,9-81,7) résistantes à la clarithromycine et 90 (78,3% ; 69,6-85,4) au métronidazole.
- Aucun des patients recevant PYLERA® + IPP n'a développé de résistance à la tétracycline.
Une PCR en temps réel appliquée à des échantillons de biopsie gastrique a détecté 416 cas de biopsies positives en culture incluant 30 nouveaux cas supplémentaires. Globalement une équivalence a été trouvée entre 158 cas de mutations de HP associées à la résistance aux macrolides et 144 cas de résistance à la clarithromycine détectée par les tests de sensibilité aux antimicrobiens (37,9% vs 37,7%).
La résistance primaire à la clarithromycine, aujourd’hui > 20%, est un facteur majeur d’échec de l’éradication d’HP. La situation est aggravée par une augmentation de résistance post-traitement dite secondaire pour 73,9% des souches d’HP.
La résistance au traitement de l’HP a jusqu’à récemment continué d’augmenter mais apparemment de façon plus lente au cours des 15 dernières années, peut être grâce à l’intense promotion de l’utilisation plus rationnelle des antibiotiques. La consommation de macrolides, notamment à longue durée d’action associés à la résistance d’HP, a diminué de 27% entre 2003 et 2013 [1].
Des freins au traitement orienté
La fibroscopie gastrique est de règle dans les situations prévues par le dépistage ciblé de HP en France, mais la culture n’est pratiquée que dans quelques dizaines de centres en France, et la recherche par PCR des résistances à la clarithromycine et /ou la lévofloxacine ne sont pas inscrits à la nomenclature et donc non remboursables [2,3].
La non observance
Après l’absence de documentation sur les résistances (traitement probabiliste), la mauvaise observance est le deuxième facteur d’échec à l’éradication d’HP.
Les traitements sont longs et les molécules employées ont chacune des effets secondaires qui peuvent se cumuler'.
Les prescriptions doivent être accompagnées d’explications pour éviter une auto-modification du traitement par le patient avec baisse de posologie, voire suppression d’une ou plusieurs molécules ou abandon complet du traitement en cours.
Une étude randomisée monocentrique en Irlande du Nord [4] a comparé l'efficacité d'une trithérapie à base de clarithromycine et l'observance du traitement dans deux groupes de patients HP + : l'un ayant bénéficié d'une information structurée et d'un suivi (groupe intervention, n=38) l'autre d'une prescription simple par le médecin généraliste (groupe contrôle, n=38). Les patients avaient été adressés à l'hôpital pour investiguer une dyspepsie par endoscopie.
Le taux d'éradication (94,7 et 73,7 % ; p=0,027) et l'observance (92,1 et 23,7% ; p<0,001) étaient significativement plus élevés dans le groupe intervention par rapport au groupe contrôle.
La fréquence d'évènements indésirables ne différait pas entre les deux groupes (50 et 44,7 % ; ns).
L’information sur l’efficacité des médicaments, leurs effets indésirables et l’importance du suivi sont les principaux facteurs d’adhésion du patient au traitement et de diminution du risque de non observance.
Références
[3] Groupe d'Etudes Français des Helicobacter (GEFH).
Qualité de la preuve : niveau 3
Mots clés : campilobacter pylori ; traitement médicamenteux ; résultats d’un traitement [campilobacter pylori ; drug therapy ; outcome, treatment].